2011年7月21日,美国食品药物管理局(下简称FDA)颁布了《移动设备医疗类App管理草案》。这是一道官方性质的条令,对“病情”进行诊断和提出治疗建议的医疗类App受到很大影响,而提供健康饮食习惯和锻炼计划的App受到的营销较小。
该草案大意如下:标签、宣称、广告等口头或文字描述中有诊断、治疗、疾病预防等用途的App将被纳入管制范围,例如厂商宣称手机的LED灯源可作为诊断光源,或宣称软件可以用于分析血糖仪读值时。草案对于相关医疗器材的管理可参考FDA医疗器材资料库。
受限的对象仅限于有“实质制造行为”的软件开发商,不包含经销商,如设计、贴标、或提供云端医疗的开发商等。
不幸的是,当时医疗类App正处于上升期。根据Health It Now网站的统计数据,从2010年到2011年,App Store中医疗类App销售量上升了250%;预计到2015年时,全球会有超过5亿人手机中装有至少一款医疗类App。当然了,前提是没受到影响。医疗类App的市场竞争激烈,高度需要创新,可想而知这个草案会有多大影响。
结果便是,要将一款医疗类App在FDA的管制之下推向市场,需要大约72个月和额外的7500万美元支出——这大概占总开发成本的77%。
Health It Now网站的执行董事Joel White解释道:“一个来自斯坦福大学的报导指出,从向FDA提交程序到最终发布的平均时长是31个月,这么长时间,足够任何程序更新换代多次。而这并不代表FDA关注的是程序是否应该被限制,他们的评判标准是这样的:医疗类App一般和电子表格、信息管理App一样,有着普遍、却不属于我们管制范围的问题,但是其中确实有一些能影响用户生理状况,App开发商并没有提供“适用于所有人”的证明,所以人与人之间的差异可能导致结果偏离实际,这些是我们管制的范围。”
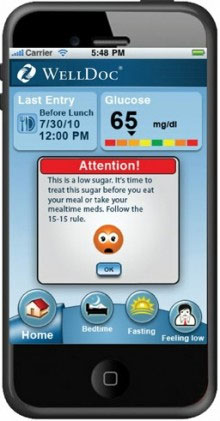
和提供“医生为患者诊断的新方式”的在线诊断类App不一样,一些医疗类App提供血压测量和脉搏监控等直接面对用户健康状况的功能。
例如WellDoc推出的“糖尿病管家”,实时对2型糖尿病患者身体状况进行反馈,并提供临床决策,而实际上这些决策的执行需要医疗设备作为基础。WellDoc的副总裁Demir Bingol说,“我们推出这款App可能会带动类似App的出现,但我们认为这类App最需要的是效率和安全性,而这正是我们一直致力于达到的标准。”
草案用词并不明确,这意味着从“根据科技发展和FDA自身能力”大方向,到“移动设备上的医疗类App”定义、App反馈对于用户人身安全的潜在威胁等等细节,FDA都会检测并分析,以决定应该对其施加怎样的限制。
重点并非是App更新换代迅速,而是随着App更新,FDA应该怎样利用原先的分析结果,推翻然后重新来过吗?更深层次而直接一些的问题是,FDA可靠吗?
即便是隶属于美国国家科学院的医学研究所,也只是说FDA的分析“有时”是对的。
“除了FDA,还有很多机构对医疗类App有着管辖权,例如FCC, FTC, CMS和ONC,只是他们的权力没有FDA那么大,”Joel White说,“国会应该对此做点什么,医疗类App行业需要他们支持。”
Health IT发现,反而是因为FDA一道道检测手续,导致开发和销售推迟,最终间接改善了人们身体健康状况。
《美国医疗保障的历史和发展》一书的作者Thomas Loker表示这个情况是意料中的,“医疗类App的发展已经到了临界点,若不加以管制,整个软件开发行业和公民们都会开始自发拒绝它们。一直以来,不管医疗保障相关产业与立法者们的关系如何,产业发展的结果对公众都是弊大于利的。”
与FDA打交道的经历对于开发者是一笔宝贵财富。很多开发者都是年轻人,没有发布App的经验,碰上FDA严格的检测会不知所措,认为自己准备不够充分并试图改进。但同时也会有部分人决定转移开发重心,规避FDA。现在医疗类App的开发必须严格遵守管制草案,于是一些公司选择终止开发,一些公司选择严格遵守,即放慢开发进度。
Joel White对此表示:“开发者如果为了绕开FDA管制而使App变得难以使用,那么App对用户的安全威胁就大大提高,价值也不复存在。”
医疗器械和辐射健康中心的国家政策研究部门副主任Nancy K. Stade在一封写给FDA的信中指出,“72个月和7500万美元两座大山,会阻止一些真正对用户有益的App的开发和使用,这对于公众健康是不利的。”
最终结果是医疗类App“被”停止了发展。
不用过多久,我们就能看到这个草案的最终归宿。因为对于移动设备上医疗类App的立法包含于《医疗器械用户收费法》,众议院和参议院将于6月底讨论出结果。国会指明要参议院参加这个立法讨论,一方面是为了合理管制移动设备上医疗类App,另一方面则是保持这个市场的竞争性。



